Contenido del Articulo
Fijación Biológica De Nitrógeno
Por: Fabian Martinez Viloria; Zootecnista

La Fijación Biológica de Nitrógeno, es una alternativa que se puede utilizar en la actualidad con el fin de disminuir la fertilización nitrogenada, ya que al ser implemetada se puede paliar una gran parte de los efectos negativos que se producen a nivel tanto medioambiental, Como a nivel sanitario.
La Fijación Biológica De Nitrógeno es realizada solo por organismos procariotas, los cuales tienen la capacidad de reducir el nitrógeno molecular a amonio tanto en vida libre como en simbiosis. El nitrógeno que es fijado en los ecosistemas terrestres, la mayor parte se realiza gracias a la asociación simbiótica de bacterias de los géneros Rhizobium, Bradyrhizobium, Sinorhizobium, Azorhizobium y Mesorhizobium, (Rhizobium para generalizar), con leguminosas, y gran parte de dichas asociaciones simbióticas son de interes agrícola.
A pesar de que en los últimos años se han incrementado los rendimientos de la FBN considerablemente, al querer llevar estos conocimientos a la Agricultura, se han encontrado una serie de limitaciones a nivel medioambiental, biológico, metodológico y a nivel de producción.
Después del agua, el nitrógeno, es el factor que más limita el crecimiento y desarrollo de las plantas. Precisamente por esta razón entre los años de 1950 – 1990 se generó un incrementó hasta 10 veces el uso de fertilizantes químicos lo cual genero un incremento de la productividad en los cereales sin precedentes, pero a pesar de esto, la aplicación de estos fertilizantes y otras acciones industriales y antrópicas han generado una alteración en las condiciones básicas del ciclo natural del nitrógeno y han contribuido a que se genere una alta contaminación por nitratos de los ecosistemas.
Que Es La Fijación Biológica De Nitrógeno
El proceso a través del cual esos microorganismos reducen el nitrógeno hasta una forma utilizable es conocido como Fijación Biológica de Nitrógeno (FBN). El proceso puede ser llevado a cabo por los microorganismos en vida libre o en simbiosis con plantas, y el mismo no sólo permite usar el nitrógeno atmosférico sino también revertir o reducir la degradación del suelo (Allan y Graham, 2002; Parsons, 2004).
La fijación biológica de nitrógeno no es más que transformar nitrógeno (N2) en amonio (NH4+), el cual se incorpora a los aminoácidos. Este proceso, solo es realizado por algunos organismos procariotas que presentan la enzima Nasa (Nitrogenasa) y que se denominan diazótrofos, es decir consumidores de Nitrógeno (di=dos; azoto=N; trofo=comer).
La Fijación Biológica De Nitrógeno es un proceso que consume entre 12 – 24 ATP por mol de Nitrógeno fijado (gran cantidad de energía), por lo que para los microorganismos constituye una vía metabólica alterna que solo podrán realizarlo siempre y cunando no tengan otra fuente de nitrógeno que necesite un costo menor de energía como el amonio (NH4+). Se podría decir que la FBN, es la forma de incorporación de Nitrógeno al suelo. Se ha estimado que del total del nitrógeno que ingresa al suelo solo el 10% es realizado por las tormentas eléctricas (precipitación atmosférica) y el 90% restante es realizado por el proceso biológico, aunque hoy en día gran parte del nitrógeno atmosférico que se incorpora al suelo proviene de la aplicación de fertilizantes químicos. El mecanismo utilizado en la producción de estos fertilizantes es basado en una reacción química que es uy parecida a la Fijación Biológica de Nitrógeno, con la diferencia que esta no utiliza la enzima Nitrogenasa (Nasa) sino que para su canalización se necesita una temperatura de 1000ºC y una presión atmósferas de 250. Este proceso es conocido como Haber-Bosch y para su realización requiere un considerable gasto de energía.
Enzima Nitrogenasa (Nasa)
Esta enzima está integrada por dos sulfo-ferro-proteínas (unidades I y II):
Unidad I (KP I): conocida como molibdo-ferro-proteína o como dinitrogenasa, la cual está constituida por cuatro subunidades peptídicas con 2 átomos de Mo, 24 átomos de Fe y 28 átomos de S. Su peso molecular es de 300 kDa aproximadamente. Esta unidad constituye el sitio catalítico del Nitrógeno (donde se da la ruptura del triple enlace N≡N)
Unidad II (KP II): denominada como nitrogenasa reductasa, la cual se conoce como un ferro-proteína que presenta posee solo dos subunidades peptídicas con solo 4 átomos de Fe y 4 átomos de S. Su peso molecular es de 60 kDa aproximadamente y participa en el transporte de e- desde las ferredoxinas hasta la unidad I, donde se acoplan al Nitrógeno para así poder formar NH3.
Las dos unidades de la enzima Nasa están codificadas en un gen conocido como nif el cual se localiza en un plásmido que posee las bacterias diazótrofas. Dicho gen es un complejo de varios genes que codifican la síntesis las unidades de la enzima Nasa (para la unidad I se conoce como nifD y para la unidad II nifK y nifH). El simple hecho de que estos genes que codifican la FBN se encuentre dentro de un plásmido ha facilitado su manipulación genética lo que ha permitido lograr grandes avances en el conocimiento de las bases bioquímicas de la FBN y la producción de organismos diazótrofos transgénicos.
La presencia de O2 es el principal factor que regula la actividad de la Nasa debido a que los e- transferidos desde la ferredoxina pueden ser captados por el O2 y no llegar a la unidad II de la Nasa. Además, una característica constante de la FBN es que cierta cantidad de los H+ transferidos son reducidos por la Nasa antes de llegar al N y se transforman en H2 (gas). La proporción de H2 formado varía según la cantidad de ATP y poder reductor que tenga disponible la célula. Se menciona que con baja disponibilidad es mayor la proporción de H2 y que, contrariamente, con alta disponibilidad predomina la formación de NH4+.
Organismos fijadores de Nitrógeno
Los organismos diazótrofos son parte de un grupo bacterias muy variado. En general la Fijación Biológica De Nitrógeno se podría decir que es de un carácter primitivo, pero altamente adaptativo. Los primeros organismos vivientes sobre la tierra, sólo disponían del Nitrógeno atmosférico para poder realizar sus funciones metabólicas, por lo que realizar fijación era una condición muy importante para la vida. Por ello los genes nif están presenten en muchas bacterias que a partir de ellas evolucionaron.
Sin embargo, en la actualidad y dadas las condiciones que se presentan a diario, la Fijación Biológica de Nitrógeno dejo de ser de carácter alternativo que se expresa generalmente cuando hay déficit de amonio en el ambiente. Además, se debe enfatizar que en la primitiva atmósfera del planeta no existía O2, las bacterias diazótrofas actuales tuvieron que desarrollar muy variados mecanismos de regulación de la tensión de O2 que le permitieron el funcionamiento de la enzima Nasa.
Entre los microorganismos involucrados en la Fijación Biológica de Nitrógeno se encuentran: bacterias, cianobacterias (algas verde-azules) y actinomicetes, los cuales fijan nitrógeno viviendo libres o en asociaciones.
Bacterias
Entre las bacterias de vida libre pueden encontrarse: anaeróbicas obligadas o facultativas (e.j. Clostridium pasteurianum, Klebsiella spp., Desulfovibrio sp.), aeróbicas obligadas (e.j. Azotobacter spp., Beijerinckia sp.) y fotosintéticas (bacterias púrpuras sulfurosas y no sulfurosas, y bacterias verdes sulfurosas) (Allan y Graham, 2002).
Las bacterias aeróbicas dependen fuertemente de las condiciones de humedad, oxígeno y materia orgánica, y las anaeróbicas son predominantes en suelos anegados donde existen las condiciones de humedad y materia orgánica, pero el suministro de oxígeno está restringido. La FBN en los suelos tropicales con las condiciones requeridas de humedad, temperatura y materia orgánica es generalmente alta. Se reporta que el número de bacterias fijadoras de nitrógeno es particularmente elevado en la zona adyacente a la raíz (rizósfera), debido a la liberación de compuestos orgánicos que le sirven como nutrimento (Dugan 2004).
Las bacterias aeróbicas emplean dos mecanismos de protección de la nitrogenasa: la protección respiratoria, donde se produce una elevada tasa respiratoria a expensas de un alto consumo de carbono y energía, manteniendo así una concentración intracelular de oxígeno baja; y la protección conformacional, en la cual la nitrogenasa cambia su disposición a una forma reversible inactiva (Robson y Postgate, 1980; Segura y Espín, 1998).
Cianobacterias
Las Cianobacterias tienen una amplia distribución y ocupan un gran rango de hábitats al igual que las bacterias, que incluyen suelo y agua, tanto de regiones tropicales y templadas como de climas extremos (Herrero et al. 2001), Presentan una gran diversidad morfológica, desde unicelulares hasta multicelulares filamentosas y con o sin la presencia de heterocistos. Stanier y Cohen-Bazire (1977), las describen como fotoautotróficas, fijadoras de CO2 a través del Ciclo de Calvin y carentes de 2- oxoglutarato deshidrogenasa. En las cianobacterias, el amonio es incorporado en esqueletos carbonados (2-oxoglutarato) a través del ciclo de la glutamina sintetasa-glutamato sintasa para la biosíntesis de glutamato y compuestos nitrogenados derivados (Herrero et al., 2001).
Presentan un metabolismo foto-lito-autótrofo con fotosíntesis exigencia, es decir son capaces de producir O2 a partir del poder reductor del agua. Gracias a la producción de O2, existe una incompatibilidad entre la fotosíntesis y la FBN, por ello algunas cianobacterias que son filamentosas debieron desarrollar un conjunto células especializadas (heterocistos) para contener la Nasa en condiciones de baja tensión de O2.
Los heterocistos consisten en células mayor tamaño que las vegetativas, que están rodeadas por una pared celular de múltiples capas (capas muy gruesas de glicolípidos, mureína y polisacáridos que no permiten que se dé la difusión del O2). La composición química de esta pared es muy variada.
Actinomicetes
Los actinomicetes son bacterias filamentosas Gram positivas, comunes en el suelo, especialmente en suelos de elevado pH y poca humedad. Se les considera como organismos intermedios entre los hongos y las bacterias, formadores de micelios (Lechevalier y Lechevalier, 1979).
Presentan forma de hifa y un metabolismo quimio-órgano-heterótrofo de respiración aerobia, por lo que las especies fijadoras de Nitrógeno desarrollaron estructuras especiales que le permiten la enzima Nasa del O2.
Todos los actinomicetes fijadores de Nitrógeno pueden vivir en simbiosis con leguminosas no leñosas y se pueden agrupar en el género Frankia. Las bacterias se alojan en grandes nódulos leñosos en contacto estrecho con el sistema vascular de la raíz y en donde a través de ella se realiza el intercambio: la planta aporta fotosintatos y la Frankia los compuestos nitrogenados.
Eubacterias
Existen bacterias verdaderas capaces de fijar Nitrógeno, todas presentan respiración aeróbica y fermentación y pueden vivir tanto libres como en simbiosis.
Bacterias diazótrofas aeróbicas de vida libre
Se pueden agrupar en el género Azotobacter, son muy comunes y están distribuidas ampliamente en el suelo. Son bacterias Gram negativas, móviles y de respiración aeróbica, por lo que para poder realizar FBN poseen adaptaciones morfológicas y fisiológicas muy importantes.
Bacterias diazótrofas micro-aeróbicas de vida libre
Son muy comunes en zonas donde existe baja tensión de O2, particularmente la rizósfera de las plantas, podemos destacar al género Azospirillum las cuales son bacterias Gram negativas de forma curva y muy móviles lo que les permite localizarse en los lugares con la tensión de O2 que sea la más adecuada para la fijación de Nitrógeno, ya que no presentan un mecanismo adaptativo que le permita hacer una regulación de la tensión de O2, por lo que en condiciones aeróbicas no fija nitrógeno y solo lo consume aminoácidos o amonio.
Bacterias diazótrofas anaeróbicas de vida libre
Son poco abundantes en el suelo porque se localizan dentro de los agregados bajo estrictas condiciones de anaerobiosis, Las especies más comunes pertenecen al género Clostridium: bacilos Gram positivos, esporulados y con metabolismo fermentativo. No necesitan mecanismos de regulación de la tensión de O2.
Bacterias diazótrofas simbióticas
Son los fijadores de Nitrógeno más conocidos por su importancia en cuanto a la cantidad de Nitrógeno fijado. Estas bacterias establecen simbiosis sólo con leguminosas (fabáceas y mimosáceas) y se las agrupa con el nombre general de rizobios el cual abarca muchos géneros taxonómicos.
Los rizobios viven en el suelo y son bacterias Gram negativas, flageladas, no esporuladas, con gran cantidad de sustancias de reserva y capas mucosas. Solo fijan Nitrógeno cuando están en simbiosis con las leguminosas ya que no poseen mecanismos para regular la tensión de O2.
Taxonomía de los rizobios
En los últimos años y debido al avance de las técnicas biomoleculares, la taxonomía de los rizobios ha sufrido grandes modificaciones, proceso que sigue en permanente avance y revisión. La clasificación más aceptada en la actualidad comprende 4 familias y 6 géneros.
Familia: Rhizobiaceae
– genero: Rhizobium. R. leguminosarum (simbionte de poroto, vicia, arveja)
– genero: Sinorhizobium. S. meliloti (melilotus) y S. medicae (alfalfa)
Familia: Bradyrhizobiaceae
– genero: Bradyrhizobium. B. japonicum (soja)
Familia: Phyllobacteriaceae
– genero: Mesorhizobium. M. ciceri (garbanzo) y M. chacoense (algarrobo)
– genero: Allorhizobium. A. undicola (Neptunia sp.)
Familia: Hyphomicrobiaceae
– genero: Azorhizobium. A. caulinodans (Sesbania sp.)
Interacción Simbiótica Rizobio-Leguminosa
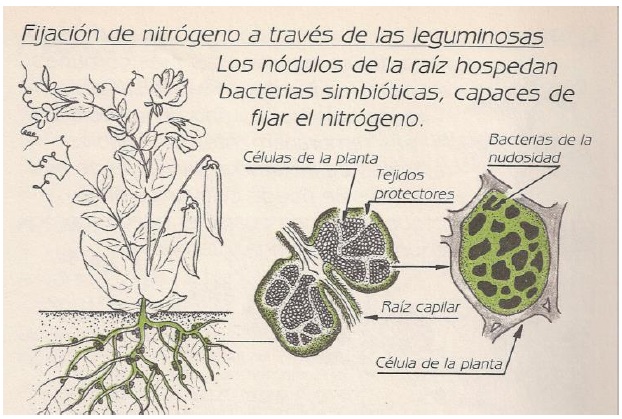
Es una de las más completas y eficientes que se conoce, ya que no solo se da un intercambio nutritivo sino que también existe un acoplamiento genético muy estrecho entre ellos para la codificación de los procesos de infección, formación de nódulos y protección de la Enzima Nasa. Por tal motivo la mayoría de dichas simbiosis son específicas es decir para cada especie de rizobio existe una leguminosa.
Para que se establezca la relación simbiótica deben ocurrir las siguientes etapas: 1. multiplicación de las bacterias en la rizósfera, 2. colonización de la rizósfera, 3. adsorción de las bacterias a la raíz, 4. ensortijamiento de los pelos radicales, ocurre en las raíces cuando la infección es vía pelos radicales y en algunas donde acontece vía unión raíces laterales-raíz principal, 5. formación de los hilos o zonas intercelulares de infección, 6. crecimiento del hilo de infección hacia las células corticales o invasión directa de las mismas, y 7. diferenciación tisular y desarrollo del nódulo. Los cambios morfológicos y fisiológicos que ocurren a nivel de los puntos de desarrollo nodular van acompañados de señales moleculares inducidas por genes propios del proceso (genes Nod) (Mayz, 1997; Perret et al., 2000; González y Marketon, 2003; Gage, 2004).
Infección

Este proceso inicia con la síntesis y excreción de productos por parte del rizobio (exopolisacáridos y fitohormonas). Estos productos se encuentran codificados en los genes nod que solo se expresan en presencia de lectinas específicas que solo la leguminosa puede sintetizar.
Dichos productos tienen la función de hacer que la epidermis del pelo radicular se debilite, lo que permitirá la entrada de la bacteria, y una vez dentro de la corteza de la raíz se forma lo sé que se conoce como cordón de infección, que no es más que un canal que se forma por la disolución de la laminilla media el cual es ocasionado por el avance de la bacteria.
Estructura Del Nódulo
Los nódulos maduros están compuestos por células radicales infectadas por rizobios, rodeadas por el tejido vascular y el meristema de la raíz. Dentro de las células corticales los rizobios sufren fuertes modificaciones morfológicas y fisiológicas y se transforman en morfotipos llamados “bacteriodes”. Estas modificaciones se producen debido a que la bacteria se especializa sólo en fijar N perdiendo todas las otras funciones vitales como son la reproducción (no sintetizan pared celular por eso se deforman) y la nutrición (pasa a depender de los fotosintatos de la planta). Sin embargo, los bacteroides mantienen las enzimas del ciclo de Krebs y la cadena respiratoria para obtener el poder reductor y los ATP necesarios para la FBN.
Los bacteriodes se encuentran rodeados por una membrana proveniente de la célula vegetal, donde se asienta una enzima reguladora de la tensión de O2: la leghemoglobina. Esta enzima es sintetizada en parte por la bacteria y en parte por la planta. La planta forma los grupos prostéticos hemo (con Fe) y la bacteria sintetiza los 4 componentes peptídicos codificados por los genes fix. La leghemoglobina transporta el O2 desde el citoplasma de la célula vegetal hasta la cadena respiratoria del bacteroide, impidiendo que llegue a la Nasa.
La forma de los bacteroides y la cantidad de bacteroides envueltos por la membrana es muy variable entre las especies. Por ej. en alfalfa hay muchos bacteroides envueltos por una sola membrana y los bacteroides son ramificados y hasta 50 veces más grandes que las bacterias libres. Contrariamente en soja solo hay un bacteroide por membrana y de tamaño y forma muy semejantes a las bacterias libres.
Funcionamiento Del Nódulo
Desde la célula entran al bacteroide: a) fotosintatos de la planta que van al ciclo de Krebs y cadena respiratoria del bacteroide para producir el poder reductor y los ATP necesarios para la FBN, b) N2 y c) O2 regulado por la leghemoglobina. Del bacteroide salen: a) CO2 producido en el ciclo de Krebs, b) H2 formado por reducción de H+, y c) NH4+ formado por actividad de la Nasa.
El NH4+ que pasa a través de la membrana se une a cadenas carbonadas existentes en el citoplasma de la célula vegetal y forma aminoácidos. Estos compuestos nitrogenados pasan al sistema vascular de la raíz y se distribuyen por toda la planta a través del xilema. Algunas especies como la soja pueden sintetizar compuestos nitrogenados con más de dos grupos aminas (ureidos) para facilitar el transporte de N a la parte aérea de la planta.
Como toda simbiosis, esta interacción se mantiene siempre que haya un costo-beneficio compartido entre las partes. Por lo tanto el hospedador tiene mecanismos de control muy estrictos para que se mantenga un balance entre costo (fotosintatos) y beneficio (compuestos nitrogenados). Los mecanismos de regulación y control determinan el número de nódulos que depende de: a) la eficiencia de fijación de las bacterias, b) la disponibilidad de N en el suelo y c) los requerimientos nitrogenados de la planta. De tal manera, si las bacterias son poco eficientes para fijar N la planta tendrá elevado número de nódulos pequeños y si existe N disponible en el suelo o la planta no requiere más N para su desarrollo, no enviará fotosintatos a los nódulos provocando su senescencia y desprendimiento.
Referencias
- Todo y; Graham P. 2002. Suelo 5611: Biología del suelo y fertilidad: fijación simbiótica de nitrógeno, otras simbiosis fijadoras de N2. Dep. de suelo, agua y clima. Universidad de Minnesota. Disponible en URL: http://www.soils.agri.umn.edu/academics/classes/soil3612/SymbioticNitrogenFixation/Other.htm .
- Dugan, 2004. Manual de capacitación de campo para analistas de laboratorio. Disponible en URL: www.home.alltel.net/mikeric/chap10up/Chapter10Nitrogen.htm .
- Gage DJ. 2004. Infección e invasión de raíces por rizobios simbióticos fijadores de nitrógeno durante la nodulación de leguminosas templadas. Microbiol. Mol. Biol. Rev.68 (2): 280-300.
- González, JE y Marketon, MM 2003. Detección de quórum en rizobia fijadora de nitrógeno. Mol.Biol.Rev. 67 (4): 574-592.
- Herrero, A., Muro-Pastor, A. M., and Flores, E. 2001. Nitrogen Control in Cyanobacteria. J. Bacteriol. 183(2):411-425.
- Lechevalier, MP y Lechevalier, HA 1979. La posición taxonómica de los endófitos actinomicetos. En Fijación Simbiótica de Nitrógeno en el Manejo de Bosques Templados. Gordon, JC, Wheleer, CT y Perry, DA (Eds.). Laboratorio de Investigación Forestal de la Universidad Estatal de Oregón, Corvallis. pp 111-121.
- Mayz, J. 1997. Simbiosis Leguminosas/Rizobia. Ediciones del Instituto de Investigaciones Agropecuarias IIAPUDO. Universidad de Oriente. Núcleo de Monagas. Maturín. Venezuela. 113 p.
- Parsons, R. 2004. Plant – Microbe Metabolism. Disponible en URL: personal.dundee.ac.uk/~rparsons/andfrank.htm.
- Perret, X., Staehelin, C., Broughton, WJ 2000. Bases moleculares de la promiscuidad simbiótica. Mol. Biol. Rev.64 (1): 180-201.
- Robson, RL y Postgate, JR 1980. Oxígeno e hidrógeno en la fijación biológica de nitrógeno. Rev. Microbiol. 34: 183-207.
- Segura, D. y Espín, G. 1998. La inactivación mutacional de un gen homólogo a Escherichia coli ptsP afecta la acumulación de poli--hidroxibutirato y la fijación de nitrógeno en Azotobacter vinelandii. Bacteriol 180 (18): 4790-4798.
- Stanier, RY y Cohen-Bazire, G. 1977. Procariotas fototróficos: las cianobacterias. Annu Microbiol 31: 225-274.
Descargar el Documento
¿Te gustaría descargar el Documento en PDF? Haz clic en el enlace que dejamos aquí debajo.
Descarga Documentos Relacionados
A continuación, te mostraremos otros documentos relacionados, solo haz clic en las imágenes que están aquí debajo.
Suscribete a Nuestra Pagina
Solo has clic en la imagen, sigue los pasos y podrás recibir en tu correo electrónico todas nuestras publicaciones.




